Do najczęściej występujących zaburzeń rytmu u dzieci i młodzieży zaliczamy tachykardię zatokową [1, 2]. Jej przyczynami są: niepokój, gorączka, nadczynność tarczycy, niedokrwistość, niewydolność serca i zapalenie mięśnia sercowego. Tachykardia zatokowa jest zwykle dobrze tolerowana, najczęściej ustępuje po usunięciu przyczyny, nie wymaga też specjalnego postępowania terapeutycznego. Arytmia, którą określamy jako częstoskurcz, to u dzieci i młodzieży istotny problem kliniczny. W Polsce napadowe częstoskurcze nadkomorowe i komorowe rozpoznawane są u kilkuset dzieci rocznie.
Częstoskurcz nadkomorowy (SVT) jest najczęstszą objawową arytmią stwierdzaną u dzieci z prawidłową anatomią serca. Może jednak współwystępować z wrodzonymi wadami serca zarówno przed leczeniem kardiochirurgicznym, jak i po nim (korekcja ubytków w przegrodzie międzyprzedsionkowej i przedsionkowo-komorowej, zespół Ebsteina, przełożenie wielkich pni tętniczych po operacji Mustarda/Senninga). Szacunkowa częstość występowania SVT w populacji dziecięcej oceniana jest na 0,1% do 0,4% [1, 3, 4]. Opisywano również rodzinną predyspozycję do występowania SVT [3].
Częstoskurcze u dzieci różnią się od tych występujących u dorosłych obrazem klinicznym, typem, historią naturalną, rokowaniem i schematem postępowania terapeutycznego.
Częstoskurcz charakteryzuje bardzo szybkie bicie serca, zwykle w spoczynku powyżej 150 uderzeń na minutę i może dochodzić nawet do 250–350 uderzeń na minutę. Objawy częstoskurczu mogą być zarówno typowe, jak i trudne do zbadania i rozpoznania. Należą do nich u dzieci starszych: uczucie szybkiego bicia serca, kołatanie, drżenie i niepokój w klatce piersiowej. Niektóre z dzieci nie odczuwają kołatania serca, lecz różnorakie, zwykle napadowo występujące objawy, takie jak zmęczenie, niepokój, napadowy kaszel, duszność, ograniczenie tolerancji wysiłku i zdenerwowanie. W większości sytuacji napady częstoskurczu pojawiają się nagle i tak samo niespodziewanie ustępują. Nie można dlatego bez zastrzeżeń zastosować „dorosłych” standardów AHA/ESC (American Heart Association/European Society of Cardiology) [1, 5, 6] dla populacji dziecięcej. Jeszcze trudniejsza w diagnostyce i terapii jest arytmia występująca u płodów i noworodków. Arytmie u płodów i noworodków są zjawiskiem powszechnym, częstość ich występowania szacuje się na 1–3% [7, 8, 9]. Większość z nich stanowią krótkotrwałe, izolowane ektopowe pobudzenia przedsionkowe, jednak epizody bradykardii lub tachykardii również się zdarzają i mogą prowadzić do zastoinowej niewydolności krążenia, obrzęku płodu czy nawet zgonu płodu/noworodka [6, 10, 11, 12, 13].
Można wyodrębnić trzy główne mechanizmy prowadzące do wystąpienia częstoskurczu nadkomorowego:
- zjawisko nawrotnej pętli z udziałem drogi dodatkowej (AVRT – Atrioventricular Re-entrant Tachycardia),
- zjawisko nawrotnej pętli bez udziału drogi dodatkowej (AVNRT – Atrioventricular nodal reentrant tachycardia),
- postać typowa (AVNRT I, slow-fast),
- postać atypowa (AVNRT II, fast-slow, long RP’),
- nadmierny automatyzm ośrodków ektopicznych: ektopiczny częstoskurcz przedsionkowy (AET – atrial ectopic tachycardia).
-
Częstoskurcz w mechanizmie nawrotnej pętli z udziałem drogi dodatkowej (AVRT)
Częstoskurcz nawrotny z udziałem dodatkowej drogi przewodzenia przedsionkowo-komorowego jest najczęstszą formą SVT występującą w populacji dziecięcej (ok. 75% SVT) [1, 3, 14, 15].
Napady częstoskurczu nadkomorowego oraz cechy preekscytacji komór w okresie międzynapadowym składają się na zespół Wolffa-Parkinsona-White’a (WPW), opisany po raz pierwszy w 1930 roku (ryc. 1) [16].
Oprócz typowego tzw. jawnego zespołu WPW (overt = manifest WPW) (ryc. 2), u części pacjentów występują tzw. ukryte oraz utajone postacie WPW) [1, 3].
Najczęstszą postacią AVRT (ok. 90%) jest częstoskurcz ortodromowy. Znacznie rzadziej spotykaną formą AVRT (ok. 10%) jest częstoskurcz antydromowy.
Pacjenci z zespołem WPW zagrożeni są nie tylko napadami częstoskurczu nadkomorowego, ale również trzepotaniem i migotaniem przedsionków, które występują wśród nich znacznie częściej niż w zdrowej populacji [3, 6, 15].
Między innymi z tego względu istotną rolę w ocenie dziecka z zespołem WPW odgrywa refrakcja drogi dodatkowej przewodzącej zstępująco.
Krótki okres refrakcji drogi dodatkowej umożliwia w razie napadu trzepotania/migotania przedsionków szybkie przewodzenie bodźców do komór i wywołanie trzepotania/migotania komór. Za krótką uważa się refrakcję poniżej 220 ms, co odpowiada zdolności do przewodzenia z częstością powyżej 270/min. Tacy chorzy są zagrożeni nagłym zgonem przy napadzie migotania przedsionków, natomiast z uwagi na niewielką różnicę refrakcji drogi fizjologicznej i drogi dodatkowej powstanie u nich pętli reentry nie jest łatwe, więc napady częstoskurczu nadkomorowego są rzadkie.
Ryc. 1. Częstoskurcz nadkomorowy 220/min o wąskich zespołach QRS (ortodromowy), bez wyraźnych załamków P u ośmioletniej dziewczynki. Po przerwaniu adenozyną rytm zatokowy 80/min z cechami preeskcytacji komór. Według informacji z wywiadu napady arytmii są sporadyczne, dobrze tolerowane – pacjentka bez stałego leczenia antyarytmicznego, niekwalifikowana również aktualnie do ablacji (przesuw papieru 25 mm/s)

Długi okres refrakcji drogi dodatkowej zabezpiecza przed szybkim przewodzeniem do komór podczas trzepotania/migotania przedsionków, stąd ryzyko nagłego zgonu jest nieznaczne. Równocześnie duża różnica refrakcji oznacza długi okres, w którym pobudzenie przedwczesne może trafić na pobudliwą drogę fizjologiczną i niepobudliwą drogę dodatkową – podstawowy warunek inicjacji pętli reentry. W tej grupie pacjentów napady częstoskurczu nadkomorowego są więc częste. Na długi okres refrakcji drogi dodatkowej pośrednio wskazuje okresowe zanikanie preekscytacji w spoczynkowym EKG (tzw. intermittujący zespół WPW) i jej ustępowanie przy przyspieszeniu rytmu serca (próba wysiłkowa, próba atropinowa).
Inną postacią częstoskurczu nadkomorowego powstającego również w mechanizmie nawrotnej pętli z udziałem drogi dodatkowej jest ustawiczny częstoskurcz węzłowy (PJRT – Permanent junctional reciprocating tachycardia, synonimy: nienapadowy częstoskurcz z długim RP’, częstoskurcz Coumela), gdzie ma miejsce wolne przewodzenie wsteczne przez drogę dodatkową. Niewielka w porównaniu do innych częstoskurczów tachykardia przez długi czas nie powoduje istotnych objawów, stąd rozpoznanie często jest opóźnione i u połowy pacjentów przy rozpoznaniu stwierdza się już cechy kardiomiopatii tachyarytmicznej [1, 3].
Ryc. 2. Rytm zatokowy u pacjentki z zespołem WPW. Widoczne cechy preekscytacji komór – skrócenie odstępu PQ oraz poszerzenie i zniekształcenie zespołów QRS (tzw. fala delta)

-
Częstoskurcz w mechanizmie nawrotnej pętli bez udziału drogi dodatkowej
Napadowy nawrotny częstoskurcz węzłowy (AVNRT) (ryc. 3A i 3B) jest drugim najczęstszym (15%) typem częstoskurczu nadkomorowego u dzieci. Pętla dla krążącego pobudzenia jest utworzona przez czynnościowo różniące się między sobą dwa szlaki przewodzenia „szybki” i „wolny”, które fizjologicznie istnieją w węźle przedsionkowo-komorowym. Komory pobudzane są – wolną lub szybką – drogą fizjologiczną, zatem zespoły QRS zawsze są wąskie.
W postaci typowej (AVNRT I, slow-fast) pobudzenie zstępuje drogą wolną, a wstępuje drogą szybką. W postaci atypowej (AVNRT II, fast-slow, long RP’) pobudzenie zstępuje drogą szybką, a wstępuje drogą wolną.
Ryc. 3A. Chłopiec 13-letni z napadami SVT od pięciu lat trwającymi od kilku do kilkunastu minut, a w ostatnich miesiącach do dwóch godzin z uczuciem słabości i szybkiego bicia serca. W zapisie EKG w trakcie trwania jednego z ostatnich epizodów zarejestrowano częstoskurcz nadkomorowy z wąskimi QRS o częstości akcji serca 236/min (przesuw papieru 25 mm/s). Pacjenta zakwalifikowano do badania elektrofizjologicznego (EPS). W trakcie EPS wielokrotnie indukowano AVNRT I (slow-fast). Wykonano aplikacje RF w okolicy drogi wolnej. W obserwacji dwuletniej arytmia nie nawróciła

Ryc. 3B. Zapis EKG u tego samego pacjenta po umiarowieniu adenozną – rytm zatokowy 120/min bez cech preekscytacji (przesuw papieru 25 mm/s)

-
Nadmierny automatyzm ośrodków ektopicznych
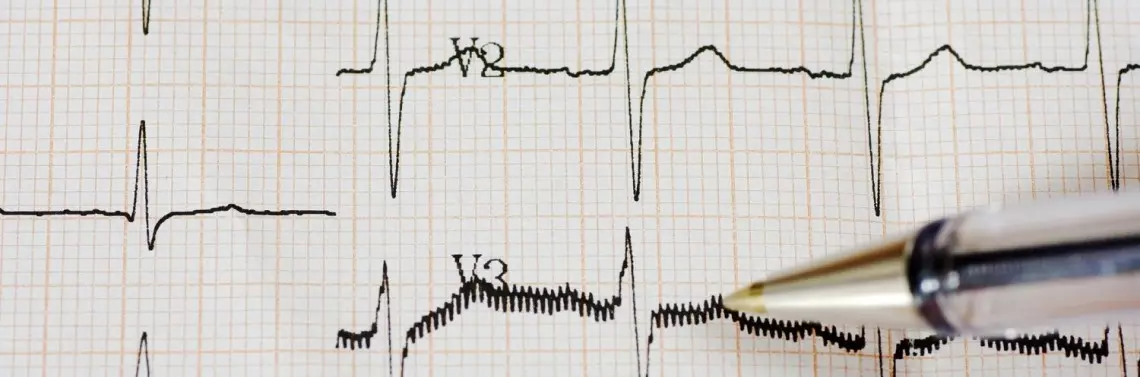
Ektopiczny częstoskurcz przedsionkowy (AET) (ryc. 4) występuje u niewielkiego odsetka dzieci z SVT. Miejscem bodźcotwórczym są tutaj komórki mięśnia przedsionka, poza węzłem zatokowym. W zapisie EKG zespoły QRS są prawidłowe, a załamki P o morfologii zależnej od miejsca powstania częstoskurczu, znajdują się przed zespołami QRS. Częstość załamków P waha się od 90 do 330/min i zależy od aktywności ogniska ektopicznego, często ulega charakterystycznym zmianom, zwłaszcza przyspieszaniu na początku i zwalnianiu na końcu napadu – tzw. warming-up i cooling-down. Częstość czynności komór zależy od sprawności przewodzenia p-k, u dzieci przeważnie przewodzenie to jest bardzo dobre, co skutkuje przewodzeniem 1:1, w przeciwieństwie do osób starszych, u których nierzadki jest blok p-k podczas częstoskurczu.
Ektopiczny częstoskurcz węzłowy (JET – Junctional Ectopic Tachycardia) powstaje w węźle przedsionkowo-komorowym lub w obrębie pęczka Hisa. Częstość rytmu komór waha się od 150 do 300/min. Przeważnie stwierdza się rozkojarzenie przedsionkowe-komorowe, z częstością rytmu komór wyższą niż częstość rytmu zatokowego przedsionków, w pozostałych przypadkach występuje wsteczne przewodzenie komorowo-przedsionkowe 1:1.
Ryc. 4. Dziewczynka 13-letnia z ustawicznym SVT. Arytmia zostala rozpoznana podczas badań kontrolnych przy kwalifikacji do aktywności sportowej. W badaniu EKG (zapis górny): ektopiczny częstoskurcz przedsionkowy – częstość załamków P 150/min – przewodzony do komór ze zmiennym blokiem. Po podaniu adenozyny (zapis dolny) uwidoczniono nasilenie stopnia bloku przedsionkowo-komorowego. Serie załamków P rozdzielone są krótkimi przerwami w aktywności przedsionków. W zapisie Holtera EKG częstoskurcz przez cały czas rejestracji. W badaniu echokardiograficznym cechy kardiomiopatii tachyarytmicznej. Dziewczynka została zakwalifikowana do badania elektrofizjologicznego i ablacji RF. W okresie dwuletniej obserwacji nie stwierdzono nawrotu arytmii, a w okresie sześciu miesięcy od przeprowadzenia ablacji RF wykazano ustąpienie echokardiograficznych cech kardiomiopatii (przesuw papieru 50 mm/s)

ARYTMIE W RÓŻNYCH OKRESACH ŻYCIA DZIECKA
Mimo że mechanizmy leżące u podłoża SVT są dobrze poznane i zrozumiane, nadal jednak niewiele wiadomo o czynnikach warunkujących pojawianie się i ustępowanie skłonności do napadów w różnych okresach życia dziecka oraz o podatności arytmii na profilaktykę antyarytmiczną [6, 9, 11, 12].
Informacje dotyczące rozwoju układu bodźcoprzewodzącego u człowieka są nadal bardzo skąpe [17]. Wiemy już, że ok. 23. dnia od zapłodnienia rozpoczynają się pierwsze skurcze serca płodu, ale rozwój i dojrzewanie układu bodźcoprzewodzącego postępuje dalej przez cały okres trwania ciąży.
Diagnostyka i terapia płodowych zaburzeń rytmu jest jedną z najmłodszych dziedzin kardiologii dziecięcej. Zaburzenia rytmu serca u płodu są rozpoznawane u ok. 2% badanych płodów w rutynowych położniczych badaniach USG
[9, 13, 18, 19]. W ponad 90% są to krótkie i izolowane incydenty o niewielkim znaczeniu klinicznym. Najczęściej stwierdza się pojedyncze pobudzenia ektopiczne nadkomorowe, następnie napadowe częstoskurcze nadkomorowe – 53%, trzepotanie przedsionków – 30% i migotanie przedsionków. Wszystkie wymienione trzy typy tachyarytmii mogą być potencjalnie letalne ze względu na wywoływanie niewydolności serca u płodu. Częstoskurcz nadkomorowy jest najczęstszym istotnym hemodynamicznie zaburzeniem rytmu u płodu (ok. 40%). SVT może być dobrze tolerowany przez płód, ale może również doprowadzać do niewydolności serca, kardiomiopatii rozstrzeniowej, a nawet zgonu. Jeśli dojdzie do obrzęku płodu, śmiertelność wynosi ok. 35%. Badanie echokardiograficzne umożliwia ocenę chronologii zjawisk elektrycznych zachodzących w przedsionkach i komorach, jednak nie w sposób bezpośredni, ale poprzez ocenę ich następstw mechanicznych.
Każdy typ częstoskurczu nadkomorowego w okresie płodowym wymaga intensywnego leczenia.
W okresie noworodkowym najczęściej rozpoznawaną tachyarytmią (SVT) jest częstoskurcz nawrotny z udziałem dodatkowej drogi przewodzenia przedsionkowo-komorowego (AVRT) i stanowi on 80% SVT.
Kolejną postacią częstoskurczów nadkomorowych jest częstoskurcz przedsionkowy stanowiący od 5–20%, może on być napadowy albo ustawiczny, w odróżnieniu od AVRT, który jest napadowy. Trzepotanie (AFlutter) (ryc. 5) i migotanie przedsionków (AFib) to niezwykle sporadycznie występujące tachyarytmie przedsionkowe u dzieci [10, 13]. Najwięcej epizodów SVT, ok. 40% wszystkich SVT rozpoznawanych w wieku pediatrycznym, występuje w okresie noworodkowym i im młodsze dziecko, tym większe ryzyko wystąpienia niewydolności serca w trakcie trwania SVT [1, 10].
Ryc. 5. Noworodek w pierwszej dobie życia. Zapis górny: częstoskurcz nadkomorowy 200/min z wąskimi QRS. W różnicowaniu trzeba uwzględnić AVRT i trzepotanie przedsionków przewodzone 1:1. Zdolność do przewodzenia przez węzeł p-k nawet 300/min występuje jedynie u najmłodszych dzieci – w późniejszym wieku węzeł przedsionkowo-komorowy traci zdolność do tak szybkiego przewodzenia. W trakcie napadu noworodek przytomny, w stanie średniociężkim, z umiarkowaną dusznością. Po podaniu adenozyny (zapis dolny) uwidoczniono trzepotanie przedsionków (przesuw papieru 50 mm/s)

Spektrum mechanizmów biorących udział w powstawaniu częstoskurczu nadkomorowego zmienia się wraz z wiekiem [1, 9, 13].
Ocenia się, że napadowy częstoskurcz nadkomorowy (SVT) występuje z częstością 1 na 200–250 żywo urodzonych noworodków i 90% z nich traci zdolność indukowania SVT do końca 1. r.ż. [1, 14] (ryc. 6). Z wiekiem maleje odsetek częstoskurczów z udziałem drogi dodatkowej, rośnie natomiast liczba nawrotnych częstoskurczów węzłowych, które dominują u dorosłych pacjentów z SVT.
Ryc. 6. Noworodek w trzeciej dobie życia, przytomny, w stanie średniociężkim, z umiarkowaną dusznością. W zapisie EKG częstoskurcz z szerokimi QRS. Powrót rytmu zatokowego bez cech jawnej preeskcytacji uzyskano po podaniu adenozyny (przesuw papieru 25 mm/s)

Aktualnie obowiązujące zasady terapii częstoskurczu nadkomorowego (SVT) w populacji dziecięcej
Leczenie częstoskurczu nadkomorowego [1, 4, 6, 7, 14] obejmuje:
- u wszystkich pacjentów – przerwanie napadu,
- u wybranych pacjentów – przewlekłą profilaktyczną terapię antyarytmiczną,
- u wybranych pacjentów – zniszczenie ogniska arytmii (ablacja).
W podejmowaniu decyzji terapeutycznych kierujemy się wytycznymi i zaleceniami ekspertów i Towarzystw Naukowych (HRS – Heart Rhythm Society, ESC, AEPC – Association for European Paediatric and Congenital Cardiology, AHA).
-
Przerywanie napadu (tabela 1)
Noworodki/niemowlęta
W okresie noworodkowym/niemowlęcym lekiem pierwszego rzutu jest adenozyna [1, 3, 13]. Przy braku skuteczności adenozyny kolejnym lekiem jest amiodaron [20].
Sporadycznie w okresie noworodkowym występują wskazania do kardiowersji elektrycznej (ECV) [1]. ECV wykonywana jest ze względu na niestabilność hemodynamiczną.
W leczeniu tachyarytmii o niejasnym mechanizmie u noworodków i niemowląt należy unikać digoksyny i werapamilu. W trzepotaniu/migotaniu przedsionków u pacjentów ze współistniejącą drogą dodatkową wymienione leki poprzez skrócenie refrakcji drogi dodatkowej i ułatwienie przewodzenia przez drogę dodatkową mogą spowodować przyspieszenie akcji komór do migotania komór włącznie [21].
Wysycenie naparstnicą zwiększa również ryzyko wywołania komorowych zaburzeń rytmu podczas ewentualnej kardiowersji elektrycznej.
Częstoskurcz nadkomorowy u płodów i noworodków jako stan zagrożenia życia wymaga podjęcia intensywnej terapii w ośrodku kardiologicznym. Wybór terapii zależy od typu częstoskurczu i stanu hemodynamicznego. W okresie 6–12 miesięcy stosuje się profilaktykę farmakologiczną celem zapobiegania nawrotom częstoskurczu.
Tab. 1. Najczęstsze objawy kliniczne występujące u niemowląt i dzieci starszych z SVT
| Niemowlęta | Dzieci starsze |
|
|
|
|
Tab. 2. Dawki leków umiarawiających stosowanych i.v. w napadzie SVT u dzieci
| Adenozyna | Adenocor 0,1–0,3 mg/kg/dawkę | Striadyna 0,25–0,5 mg/kg/dawkę |
| Werapamil* Propafenon Flekainid Amiodaron Sotalol Propranolol* Digoksyna Ajmalina |
0,1–0,3 mg/kg 0,5–2 mg/kg 1–2 mg/kg max 20 mg/kg w pierwszej dobie, dawki po 5 mg/kg we wlewach 1–2 godz. 1–2 mg/kg 0,01–0,025–0,1 mg/kg (ostrożnie!!!) dawka nasycająca od 0,02 mg/kg/dobę (co 8 godzin: 1/2+1/4+1/4 dawki) 0,5–1 mg/kg |
|
* nie podawać u niemowląt
Tab. 3. Dawki leków stosowanych doustnie w profilaktyce napadów SVT u dzieci
| Werapamil Propafenon Flekainid Amiodaron* Sotalol Propranolol Metoprolol Atenolol Dogoksyna* |
2–7 mg/kg/dobę 8–20 mg/kg/dobę 2–6 mg/kg/dobę dawka nasycająca 10–15 mg/kg/dobę, podtrzymująca 3–5 mg/kg/dobę 1–5 mg/kg/dobę 1–5 mg/kg/dobę 0,5–2 mg/kg/dobę 1–2 mg/kg/dobę dawka nasycająca od 0,03 mg/kg/dobę, podtrzymująca 0,005–0,01 mg/kg/dobę |
*często z przerwą 1-2 dni w tygodniu
Dzieci z objawami niewydolności krążenia
U dzieci z objawami niewydolności krążenia (wstrząs lub znaczna hipotensja, zaburzenia świadomości, obrzęk płuc) leczeniem z wyboru jest kardiowersja elektryczna. Zabieg wykonuje się zależnie od pilności wskazań: niezwłocznie bez sedacji, w sedacji (midazolam 0,1 mg/kg/2 minuty i.v.) lub w pełnym znieczuleniu ogólnym z intubacją. Zalecana wielkość łyżek defibrylatora to 4,5 cm dla niemowląt ważących poniżej 10 kg, a 8–12 cm dla pozostałych. Jeśli nie są dostępne łyżki pediatryczne, należy użyć łyżek dla dorosłych w pozycji przednio-tylnej. Nacisk wywierany na łyżki podczas wyładowania jest również mniejszy niż przyjęty u osób dorosłych – 3 kg u dzieci < 10 kg, 5 kg u dzieci < 8 lat, 8 kg u dzieci > 8 lat i u osób dorosłych. Energia wyładowania wynosi 0,5 – 1 – 2 J/kg dla kardiowersji zsynchronizowanej i 2–4 J/kg dla defibrylacji.
Największym niebezpieczeństwem związanym z częstoskurczem jest nagły spadek wydolności serca i spadek ciśnienia tętniczego krwi, co prowadzi do stanów przedomdleniowych, omdleń, a w sytuacjach krytycznych do nagłego zatrzymania krążenia. W przypadku nagłej utraty przytomności, braku wyczuwalnego tętna i oddechu, niezwłocznie należy podjąć czynności reanimacyjne i wezwać karetkę pogotowia.
Warto jednak pamiętać, że każdy, nawet dobrze tolerowany napad częstoskurczu u dzieci, powinien być zgłoszony lekarzowi pierwszego kontaktu, który zaleci odpowiednie badania i leczenie zależnie od rozpoznania lub skieruje do specjalisty od zaburzeń rytmu – lekarza elektrofizjologa.
Wdrożenie leczenia i jego intensywność zależne są od rodzaju zaburzenia czynności serca, od dolegliwości i możliwych ich konsekwencji. Choroba może mieć przebieg łagodny, potencjalnie złośliwy czy złośliwy. Leczenie arytmii jest najskuteczniejsze, jeśli przyczyna choroby jest rozpoznana i możliwa do usunięcia.
Adenozyna
Lekiem z wyboru w przerywaniu częstoskurczu jest adenozyna. Mechanizm działania antyarytmicznego adenozyny polega na czasowym zablokowaniu przewodzenia w węźle przedsionkowo-komorowym. W częstoskurczach nawrotnych, w których węzeł ten jest integralną częścią pętli pobudzenia nawrotnego (AVRT i AVNRT), przerwanie pętli powoduje przerwanie częstoskurczu. Czas półtrwania adenozyny wynosi 15–20 sekund, stąd w odróżnieniu od wszystkich innych leków antyarytmicznych, adenozynę podaje się w szybkim bolusie i dodatkowo „popycha” podaniem soli fizjologicznej. Skuteczność jej działania zależy od wytworzenia chwilowego wysokiego stężenia w sercu – dużo bardziej zależy od miejsca podania (wkłucie obwodowe czy centralne) i szybkości bolusu niż od wielkości dawki w mg/kg.
Typowy obraz EKG po podaniu adenozyny to zahamowanie zatokowe do kilku sekund, a następnie powrót rytmu zatokowego, czasem poprzedzonego kilkoma pobudzeniami o poszerzonych zespołach QRS – komorowymi lub zaberrowanymi.
Oprócz korzyści terapeutycznych (przerwanie częstoskurczu nawrotnego) podanie adenozyny może mieć w pewnych sytuacjach duże walory diagnostyczne. W częstoskurczach przedsionkowych ektopicznych oraz w trzepotaniu przedsionków przewodzonych w stosunku 1:1 lub 2:1 podanie adenozyny może zwiększyć stopień bloku i ujawnić załamki P bądź fale trzepotania, naprowadzając na właściwe rozpoznanie. Przerwanie adenozyną częstoskurczu o szerokich zespołach QRS wskazuje raczej na częstoskurcz nadkomorowy z zaburzeniami przewodnictwa śródkomorowego lub częstoskurcz antydromowy w zespole WPW niż na częstoskurcz komorowy. Częstoskurcze komorowe są znacznie rzadziej spotykane u dzieci niż u dorosłych, dlatego u dziecka częstoskurcz z szerokimi zespołami QRS jest najczęściej nadkomorowy z aberracją lub antydromowy, podczas gdy w populacji dorosłej jest najczęściej komorowy.
Zabiegi stymulujące nerw błędny
W stosunku do łagodnie przebiegających częstoskurczów, niewiążących się ze spadkiem ciśnienia tętniczego i omdleniami, napad może być przerwany poprzez silne napięcie mięśni budujących ścianę klatki piersiowej, mięśnie brzucha i serce. Pomocne w przerwaniu napadu jest wywołanie silnego kaszlu lub nabranie głębokiego oddechu i silne napięcie mięśni brzucha. Jest to tzw. próba Valsalvy. Niektórym dzieciom pomóc może kucnięcie, picie zimnej wody lub szybkie wypicie napoju gazowanego, czyli zabiegi stymulujące nerw błędny; powoduje to zwolnienie przewodzenia w węźle przedsionkowo-komorowym i przerwanie pętli reentry.
Jeśli częstoskurcz nie ustępuje po zabiegach stymulujących nerw błędny ani po adenozynie, lekami kolejnego rzutu są: werapamil, beta-blokery, propafenon, ajmalina, flekainid, amiodaron, sotalol, digoksyna. Wybór leku zależy od rodzaju arytmii, wieku dziecka i stanu klinicznego.
W częstoskurczu w zespole WPW zaleca się propranolol, propafenon, flekainid, amiodaron, sotalol, ajmalinę. Digoksyna jest przeciwwskazana, a werapamil „niezalecany” w częstoskurczach u pacjentów z jawnym zespołem WPW – oba te leki mogą u części pacjentów powodować skrócenie refrakcji drogi dodatkowej. Nie ma to istotnego znaczenia przy częstoskurczu nawrotnym, a leki te, zwalniając przewodzenie w węźle przedsionkowo-komorowym, często przerywają pętlę pobudzenia nawrotnego i częstoskurcz. Natomiast przy trzepotaniu/migotaniu przedsionków ułatwienie przewodzenia przez drogę dodatkową skutkuje przyspieszeniem czynności komór, łącznie z ryzykiem przewodzenia 1:1 i wywołania migotania komór. Ponieważ możliwe jest zarówno mylne rozpoznanie trzepotania przedsionków jako częstoskurczu, jak i przejście częstoskurczu w trzepotanie/migotanie, z tego względu stosowanie digoksyny i werapamilu w zespole WPW jest ryzykowne. Wysycenie naparstnicą zwiększa również ryzyko wywołania komorowych zaburzeń rytmu podczas ewentualnej kardiowersji.
W częstoskurczach u dzieci bez zespołu WPW lekiem drugiego rzutu po adenozynie może być werapamil, a w dalszej kolejności propranolol, propafenon, flekainid, amiodaron, sotalol, digoksyna, ajmalina.
U dzieci z objawami niewydolności krążenia niewskazane są leki działające inotropowo ujemnie (werapamil, beta-blokery, propafenon, flekainid, ajmalina), a niezastąpionym lekiem pozostaje tu amiodaron [1, 20].
U niemowląt nie należy podawać dożylnie werapamilu ani propranololu z uwagi na ryzyko ciężkiej bradykardii/asystolii lub hipotensji.
W przerywaniu częstoskurczów nawrotnych stosowana jest z powodzeniem również stymulacja przezprzełykowa lub przezżylna o częstości stymulacji nieco wyższej niż często-
skurcz (overdriving).
-
Leczenie profilaktyczne
Decyzja o leczeniu profilaktycznym zależy od wielu czynników, takich jak: wiek pacjenta, częstość występowania napadów, czas ich trwania i towarzyszące im objawy kliniczne oraz oceny ryzyka nagłego zgonu. Jak przy każdej terapii, należy tu wyważyć bilans korzyści i ryzyka przewlekłego stosowania leków antyarytmicznych, m.in. uwzględniając proarytmiczne działanie tych leków.
U noworodków i niemowląt często włącza się leczenie profilaktycznie na okres 1 roku po pierwszym incydencie częstoskurczu nadkomorowego – niezależnie od czasu trwania i tolerancji napadu [3, 9, 13]. Takie postępowanie wynika z większego ryzyka przeoczenia napadów oraz niewydolności krążenia u niemowlęcia. Rodziców należy nauczyć pomiaru tętna u dziecka, aby przy pierwszych objawach rozpoznać arytmię – zanim dojdzie do niewydolności krążenia. W profilaktyce SVT stosuje się naparstnicę, beta-blokery, propafenon, flekainid, amiodaron, sotalol. W profilaktyce częstoskurczów ektopicznych najczęściej skuteczne są: propafenon, amiodaron i flekainid [1, 3, 20, 21]. Wymienione leki stosuje się w monoterapii bądź w leczeniu skojarzonym, terapię dobiera się indywidualnie dla konkretnego pacjenta i często empirycznie, kierując się objawami klinicznymi, stężeniem leku w surowicy (o ile jest taka możliwość), zapisami holterowskimi.
Dzieci starsze ze sporadycznymi, dobrze tolerowanymi napadami częstoskurczu nadkomorowego nie wymagają przewlekłego leczenia antyarytmicznego.
Pacjenci z poważnymi objawami bądź bardzo częstymi napadami częstoskurczu wymagają przewlekłej profilaktyki zarówno ze względu na komfort życia, jak i celem zapobieżenia rozwojowi kardiomiopatii tachyarytmicznej. W leczeniu profilaktycznym wykorzystywane są wymienione w tabeli 2
leki antyarytmiczne. U niemowląt nie zaleca się podawania werapamilu.
W profilaktyce częstoskurczów nawrotnych bez udziału drogi dodatkowej oraz w utajonym zespole WPW stosuje się naparstnicę, beta-blokery, propafenon, flekainid, amiodaron, sotalol, werapamil. W profilaktyce częstoskurczu w jawnym zespole WPW stosuje się ww. leki z wyłączeniem naparstnicy i werapamilu. W profilaktyce częstoskurczów ektopicznych najczęściej skuteczne są: propafenon, flekainid, amiodaron.
Wymienione leki, tak jak u noworodków, stosuje się w monoterapii bądź w leczeniu skojarzonym, terapię dobiera się indywidualnie dla konkretnego pacjenta i często empirycznie, kierując się objawami klinicznymi, stężeniem leku we krwi, zapisami holterowskimi.
-
Ablacje
Ablacja, czyli zniszczenie przy użyciu prądu wysokiej częstotliwości bądź niskiej temperatury, drogi dodatkowej albo ogniska ektopicznego, jest dostępna również w populacji pediatrycznej. Według danych Kugler i wsp. [22] skuteczność tej metody leczenia waha się od 83 do 96%. Nie dotyczy to dzieci najmłodszych, u których zniszczenie ogniska arytmogennego powoduje powstanie blizny rozleglejszej w proporcji do wielkości serca niż w starszych grupach wiekowych, a ryzyko powikłań zabiegu (blok całkowity, perforacja) jest również większe [22].
Ablacja RF (prądem o częstotliwości radiowej) stała się rutynową metodą leczenia napadowego częstoskurczu nadkomorowego (SVT) i komorowego u dzieci po 5. r.ż. [1, 14]. W uza-
sadnionych klinicznie przypadkach badanie elektrofizjologiczne i ablację RF wykonuje się u dzieci młodszych. Skuteczność zabiegów ablacji RF u dzieci jest duża i wynosi około 90%
[1, 14, 23, 24]. W wielu ośrodkach na świecie, również w Polsce, do leczenia SVT u dzieci wprowadza się metodę krioablacji (temperatura krioablacji ok. –75°C). Jest to metoda z założenia przeznaczona dla dzieci z częstoskurczami węzłowymi lub częstoskurczami przedsionkowo-komorowymi (p-k) z dodatkową drogą przewodzenia zlokalizowaną blisko łącza p-k (drogi antero- i midseptalne). Krioablacja zmniejsza ryzyko uszkodzenia węzła p-k podczas zabiegów w jego okolicy oraz zapewnia dużą stabilność elektrody podczas zabiegu, ale odsetek nawrotów zaburzeń rytmu po zabiegu krioablacji jest większy w porównaniu z metodą RF.
Nadal oczekuje się na szczegółowe dane dotyczące skuteczności krioablacji dróg dodatkowych okołowęzłowych
u dzieci.
W arytmiach nadkomorowych, tj. zespole WPW, częstoskurczach węzłowych, częstoskurczach przedsionkowych czy trzepotaniu przedsionków, ablacja uznawana jest jako leczenie pierwszego rzutu (leczenie z wyboru) w zapobieganiu arytmii i jej powikłaniom [1, 14]. Oznacza to, że w opinii ekspertów Europejskiego Towarzystwa Kardiologicznego istnieje więcej korzyści i większe jest bezpieczeństwo dla chorego w przeprowadzeniu zabiegu ablacji niż w leczeniu farmakologicznym, które w przypadku dzieci i młodzieży jest trudne.
Ablacje u dzieci i młodzieży stosowane są w Polsce w kilku wyspecjalizowanych ośrodkach kardiologii dziecięcej. Zabiegi ablacji u dzieci wykonywane są przez doświadczonych elektrofizjologów ablacyjnych.
Kolejnym krokiem do poprawy bezpieczeństwa jest wprowadzanie nowoczesnych systemów elektroanatomicz-
nych 3D. Podczas klasycznej ablacji fluoroskopia rentgenowska umożliwia lokalizację elektrod w trakcie badania elektrofizjologicznego i ablacji. Wykonanie przez system 3D mapy anatomicznej oraz wizualizacja elektrod znajdujących się w sercu umożliwia ograniczenie promieniowania, a w wielu przypadkach całkowite jego wyeliminowanie.
Ryc. 7. Algorytm „Postępowanie z dzieckiem z podejrzeniem częstoskurczu nadkomorowego” stosowany w jednostce autorów publikacji

Nowoczesne systemy do mapowania elektroanatomicznego (m.in. EnSite, St Jude Medical oraz Carto 3, Biosense Webster), według publikacji z ostatnich lat, pozwalają na skuteczne i bezpieczne wykonanie zabiegów ablacji u dzieci, z ograniczeniem czasu fluoroskopii o > 70%. Skuteczność zabiegów z użyciem systemów elektroanatomicznych jest porównywalna ze skutecznością zabiegów klasycznych.
W ostatnich latach coraz więcej jest doniesień przemawiających za koniecznością rozważenia wykonania zabiegu ablacji u dzieci z bezobjawową preekscytacją komór (zespół Wolffa, Parkinsona i White’a – WPW). Dane z 2009 roku wskazywały na możliwość rozwoju tachyarytmii (w tym potencjalnie groźnych dla życia) u 28% bezobjawowych dzieci z zespołem WPW [15, 25].
Nadal jednak są znaczne trudności w uzyskaniu wysokiej skuteczności leczenia farmakologicznego i zabiegów ablacji u dzieci z częstoskurczami przedsionkowymi (ektopowymi i nawrotnymi) po zabiegach kardiochirurgicznych w przeciwieństwie do dzieci z anatomicznie zdrowym sercem, u których wyniki leczenia częstoskurczu przedsionkowego są wyraźnie lepsze, ale nadal niezadowalające.
Piśmiennictwo
- J. Brugada, N. Blom, G. Sarquella-Brugada i wsp. European Heart Rhythm Association; Association for European Paediatric and Congenital Cardiology: Pharmacological and non-pharmacological therapy for arrhythmias in the pediatric population: EHRA and AEPC-Arrhythmia Working Group joint consensus statement. Europace 2013; 15: 1337–1382.
- J. Kwiatkowska, A. Stanko, K. Lisowska. Zasady wykonywania I interpretacji EKG u dzieci. Forum Pediatrii Praktycznej 2017; 14:41–45.
- J. C. Perry. Supraventricular Tachycardia, w: The Science and Practice of Pediatric Cardiology. A. Garson Jr, J.T. Bricker, D.J. Fisher i wsp. (red). Williams & Wilkins, Baltimore, Maryland 1998.
- C. Blomström-Lundqvist, M. M. Scheinman, E. M. Aliot i wsp.: ACC/AHA/ESC guidelines for the management of patients with supraventricular arrhythmias – executive summary: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines, and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to Develop Guidelines for the Management of Patients With Supraventricular Arrhythmias.). J Am Coll Cardiol 2003; 42: 1493–1531.
- Writing Committee Members, R. L. Page, J. A. Joglar, M. A. Caldwell i wsp.: 2015 ACC/AHA/HRS guideline for the management of adult patients with supraventricular tachycardia. A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society. Heart Rhythm 2016;13:e136–e221.
- E. P. Walsh. Clinical approach to diagnosis and acute management of tachycardias in children (w): Cardiac Arrhythmias in children and young adults with congenital heart disease. E. P. Walsh, J. P. Saul,
- J. K. Triedman (red.). Lippincott Williams & Wilkins, Philadelphia, 2001.
- K. K. Wong, J. E. Potts, S. P. Etheridge, S. Sanatani. Medications used to manage supraventricular tachycardia in infant. A North American Survey. Pediatr Cardiol 2006;27:199–203.
- J. M. Simpson, A. Milburn, R. W. Yates, D. J. Maxwell, G. K. Sharland. Outcome of Intermittent Tachyarrhythmias in the Fetus. Pediatr Cardiol 1997:18;78–82.
- S. Moodley, S. Sanatani, J. E. Potts, G. G. S. Sandor. Postnatal outcome in patients with fetal tachycardia. Pediatr Cardiol 2013; 34:81–87.
- M. Pia Calabro, M. Cerrito, F. Luzza, G. Oreto. Supraventricular tachycardia in infants: epidemiology and clinical management. Current Pharmacological Design 2008;14: 723–728.
- S. Sanatani, R. M. Hamilton, G. J. Gross. Predictors of refractory tachycardia in infants with supraventricular tachycardia. Pediatr Cardiol 2002; 23: 508–512.
- S. V. Yildirim, F. Tiker, N. Cengiz et al. Reccurent supraventricular tachycardia in a newborn treated with amiodarone: Is hyper-kalemia the apperent causa? Pediatr Cardiol 2005; 26: 879–880.
- K. A. Hinkle et al. Postnatal Outcomes of Fetal Supraventricular Tachycardia: A Multicenter Study Pediatr Cardiol 2017; 29.
- S. J. Philip, R. J. Kanter, D. Abrams i wsp.: PACES/HRS expert consensus statement on the use of catheter ablation in children and patients with congenital heart disease: developed in partnership with the Pediatric and Congenital Electrophysiology Society (PACES) and the Heart Rhythm Society (HRS). Heart Rhythm 2016; 13: e251–e289.
- S.M. Al-Khatib, A. Arshad, S. R. Das i wsp.: Risk stratification for arrhythmic events in patients with asymptomatic pre-excitation. A systematic review for the 2015 ACC/AHA/ HRS Guideline for the management of adult patients with supraventricular tachycardia. Heart Rhythm 2016; 13: e222–e237.
- L. Wolff, J. Parkinson, P. D. White: Bundle-branch block with short P-R interval in healthy young people prone to paroxysmal tachyardia. Am Heart J 1930; 5: 685–704.
- M. L. Bakkler, V. M. Christoffels, A. F. M. Moorman. The cardai pacemaker and conduction system develops from embryonic myocardium that retains its primitive phenotype. J Cardiovasc Pharmacol 2010;56:6–15.
- J. Szymkiewicz-Dangel w: Zaburzenia rytmu serca. (red). Kubicka K, Bieganowska K. PZWL, Warszawa 2001; 7: 78–95.
- P. L. Ferrer. Fetal arrhythmias. In: Current Concepts in Diagnosis and Management of Arrhythmias in Infants and Children. Red: Deal B. Armonk, NY: Futura Publishing Co., Inc.; 1998, 2, 17–63.
- F. Drago, A. Mazza, P. Guccione et al. Amiodaron used alone or in combination with propranolol: a very effective therapy for tachyarrhythmias in infants and children. Pediatr Cardiol 1998;19: 445–449.
- P. P. Karpawich, M. D. Pettersen, P. Gupta, N. Shah. Infants and children with tachycardia: natural history and drug administration. Current Pharmacological Design 2008;14: 743–752.
- J. D. Kugler i wsp.: Radiofrequency catheter ablation for paroxysmal supraventricular tachycardia in children and adolescents without structural heart disease. Am J Cardiol 1997; 80:1438–1443.
- P. C. Lee, B. Hwang, S.A. Chen i wsp.: The results of radiofrequency catheter ablation of supraventricular tachycardia in children. Pacing Clin Electrophysiol 2007; 30: 655–661.
- J. Kwiatkowska, T. Królak, S. Budrejko, P. Potaż. Skuteczność i bezpieczeństwo inwazynego leczenia arytmii nadkomorowych u dzieci – doświadczenia własne. Forum Medycyny Rodzinnej 2015;3:279–281.
- V. Santinelli, A. Radinovic, F. Manguso i wsp.: The natural history of asymptomatic ventricular pre-excitation a long-term prospective follow-up study of 184 asymptomatic children. J Am Coll Cardiol, 2009; 53: 275–280.